1.1. Comment définir la vie ?
D’un point de vue purement rationnel, c’est-à-dire en faisant abstraction de concepts philosophiques, spirituels ou religieux, la vie est un phénomène physique1. L’approche scientifique de ce phénomène a initialement été développée par le physicien autrichien Erwin Schrödinger (1887-1961) (photo ci-contre de la Nobel Foundation) qui publia en 1944 un livre sur le sujet : What is Life ? (« Qu’est-ce que la vie ? »).
Une définition unique et indéniable est difficile à établir en ce sens qu’il faut tenir compte de l’existence de niveaux d’organisation structurels, d’émergence, d’homéostasie2, d’entropie3 et de métabolisme pour éviter de se retrouver dans une « zone grise », c’est à dire qui fait intervenir des concepts non scientifiques.
La définition suivante semble limiter les zones grises4 : « Mode d’organisation de la matière générant des formes diverses, de complexités variables, en interaction et ayant comme propriété principale de se répliquer presque à l’identique en utilisant les matériaux et l’énergie disponibles dans leur environnement, auquel elles peuvent s’adapter. L’expression ‘presque à l’identique‘ réfère aux mutations qui apparaissent lors de la réplication de l’organisme et qui peuvent conférer un avantage adaptatif à celui-ci. La vie se manifeste à travers des structures matérielles appelées ‘organismes vivants‘, ou ‘êtres vivants’, reconnaissables par la grande complexité de leur structure interne et leur activité autonome. La vie est un état organisé et homéostatique de la matière. »


Christian De Duve (1917-2013) simplifie cette définition et la transpose aux « êtres vivants »: « Système thermodynamique ouvert, se maintenant dans un état ordonné, éloigné de l’équilibre et capable de se dupliquer grâce à des flux continus d’énergie et de matière. » Construire une cellule : Essai sur la nature et l’origine de la vie, Bruxelles, De Boeck-Wesmael, 1990. Prix Nobel de physiologie ou médecine en 1974 (photo ci-contre).
Remarques importantes
Certains scientifiques émettent des réserves quant à vouloir absolument définir « la vie » : « Il n’existe pas de définition largement acceptée de la ‘vie’. Les définitions proposées se heurtent à des problèmes, souvent sous la forme de contre-exemples solides. Nous nous appuyons ici sur les recherches philosophiques sur le langage pour soutenir que la définition de la ‘vie’ pose actuellement un dilemme analogue à celui rencontré par ceux qui espéraient définir « l’eau » avant l’existence de la théorie moléculaire. En l’absence d’une théorie analogue de la nature des systèmes vivants, une controverse interminable sur la définition de la vie est inéluctable. » 5
Récemment, le concept de « LYFE » est apparu : un néologisme dérivé de l’anglais life que l’on peut traduire par « vye », « le vyvant » ou « vie universelle », est un essai de définition de ce que pourrait être la vie en général, au-delà des définitions restrictives de la vie sur Terre. Wikipedia (FR) .
1.2. Les grands groupes d’êtres vivants
La première distinction fondamentale entre les êtres vivants a été déterminée par le biologiste français Edouard Chatton (1883-1947). Ce dernier a observé que la structure cellulaire des organismes était de deux types : avec ou sans noyau défini. Il appela les premiers « Eucaryotes » (= vrai noyau) et les seconds « Procaryotes » (= avant noyau). Depuis les travaux de Carl Woese (1928-2012), les organismes vivants sont regroupés en trois « Domaines »: les Eukarya, les Bacteria et les Archaea. On considère que les Procaryotes regroupent les Bacteria et les Archaea.
D’après des données récentes en génétique moléculaire et en bioinformatique, les lignées englobant la totalité de la biodiversité sont représentées en un diagramme appelé « The tree of Life »6. Dans ce schéma, l’homme se situe quelque part dans la branche Opisthokonta7.
A noter que ces données ne mentionnent pas les virus, dont l’appartenance aux êtres vivants tels que décrits plus haut est généralement rejetée. Toutefois, la géométrie de cet « Arbre de vie » est en constante évolution et des découvertes récentes donnent à penser que certains virus « géants »8 pourraient s’insérer dans cette représentation.
1.3 Quand la vie sur Terre est-elle apparue ?
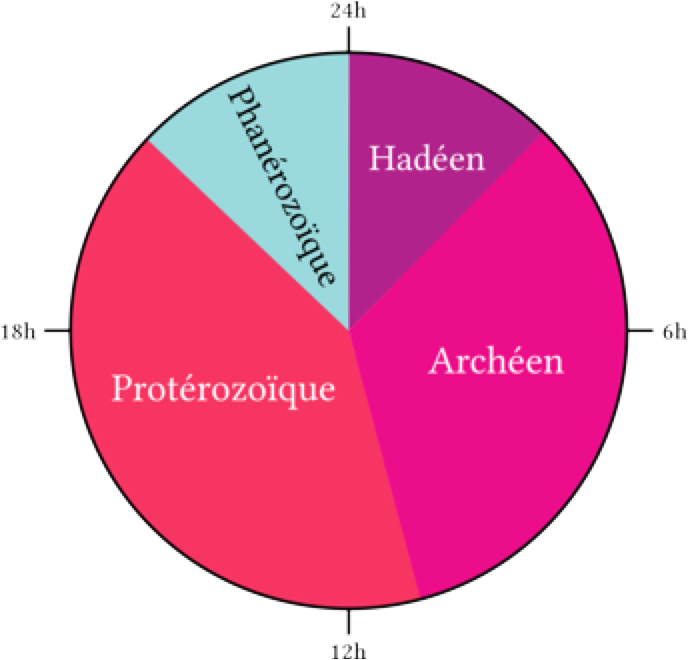
Si on admet généralement que les Procaryotes ont existé avant les Eucaryotes, on peut aussi s’interroger sur leur apparition au cours des temps géologiques. L’âge de la Terre est, selon les connaissances actuelles, estimé à 4,54 ±1% Ga (Giga-annum = 1 milliard d’années). D’après de récentes découvertes, du carbone biogénique (d’origine vivante) pourrait déjà être apparu il y a 4,1 Ga9. Les premières structures assimilables à des fossiles seraient apparues entre -4,28 et -3,77 Ga10. Le tout est de savoir sous quelle forme existaient ces premiers organismes. Sans entrer dans les détails de théories complexes et sans cesse en développement, on appelle les hypothétiques premières cellules capables de réplication « LUCA » (Last Universal Common Ancestor). Elles seraient apparues entre -3,5 et -3,8 Ga et c’est à partir de cette entité que tous les autres phyla ont évolué. Quant à « LECA » (Last Eukaryotic Common Ancestor), il serait apparu au début de l’ère Paléoprotérozoïque c-à-d vers -2,5 Ga. Récemment, des molécules supposées appartenir au « chaînon manquant » entre les procaryotes et les eucaryotes a été mis en évidence dans des roches datant de -1,6 Ga 10a .
Ce n’est que beaucoup plus tard, vers -440 Ma (Mega-annum = 1 million d’années), que les premiers végétaux ont colonisé le milieu terrestre. Les premiers animaux aériens (des arthropodes) sont eux apparus vers -410 Ma. Le schéma ci-dessus représente les âges successifs de la Terre projetés sur une durée de 24 heures. L’Homme (Homo sapiens) est alors âgé d’environ … 7 secondes !
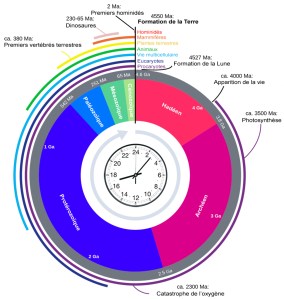
Les histoires de la Terre et de la vie sont aussi résumées sur la figure ci-contre par quelques étapes essentielles : soit des événements géologiques fondateurs pour le milieu de vie qu’est la terre soit des innovations majeures apparues dans le monde vivant. Il apparait que la vie a été très longtemps archéenne et bactérienne et qu’elle est presque aussi ancienne que la Terre.11
1.4. De quels éléments sont composés les êtres vivants ?
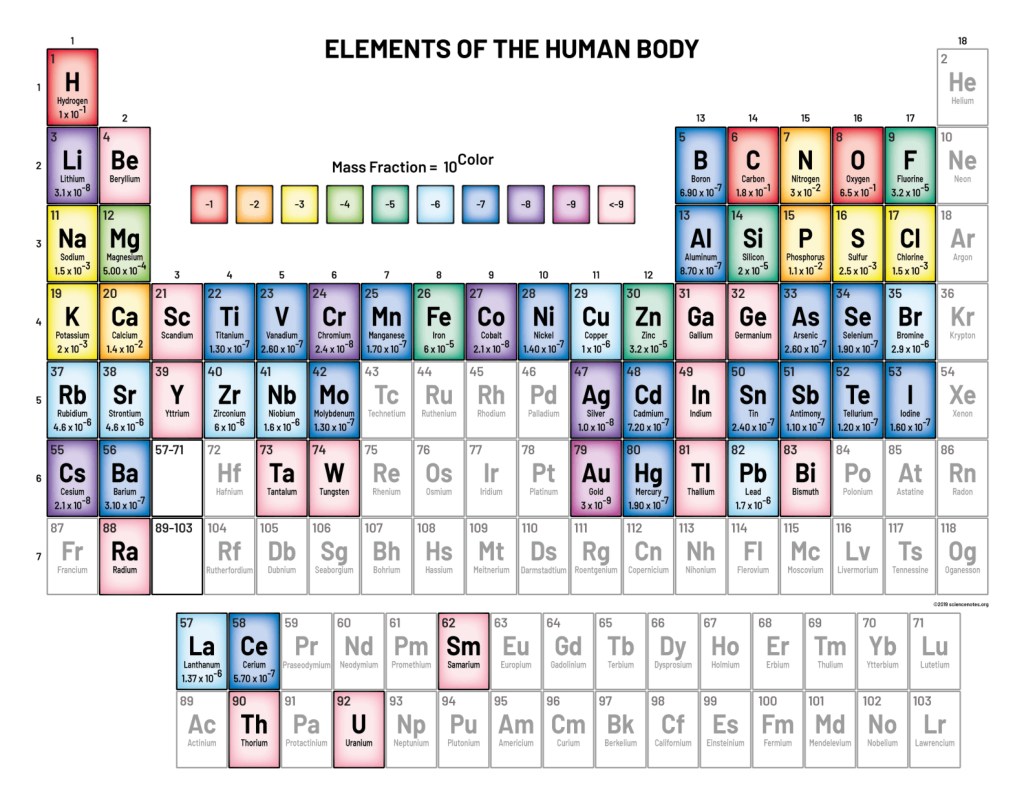
Il existe dans la nature 94 éléments dont 80 ont au moins un isotope stable12. Parmi ceux-ci, une cinquantaine ont été décelés dans les êtres vivants (abondance variable). Seulement une trentaine d’entre eux sont indispensables aux métabolismes. On appelle matière organique la matière fabriquée par les êtres vivants. Celle-ci est par définition constituée principalement de l’élément chimique carbone (C), les autres étant l’hydrogène (H), l’oxygène (O) et l’azote (N). Le phosphore (P) et le soufre (S) sont également des constituants de la matière organique mais en moindre quantité.
A titre d’exemple, voici la composition en éléments d’un être humain13:
Les données sont exprimées en fraction massique : la fraction massique wi de l’élément i est le rapport de la masse mi de cet élément à la masse totale mtot du corps: wi = mi/mtot . Notons que les éléments dont wi ≥ 5.104 sont appelés communément macroéléments. D’autres éléments sont également présents mais beaucoup moins abondants : les microéléments (> 1mg/kg = 1 ppm) et aussi à l’état de traces (< 1 ppm) : les oligoéléments. Curieusement, le silicium est l’élément le plus abondant dans la croûte terrestre après l’oxygène, soit 25,7 % de sa masse, mais il n’est présent qu’en relativement faible quantité dans la matière constituant le vivant. Il y a cependant des exceptions, certains organismes : les éponges Hexactinellides14 (animaux primitifs), les algues diatomées15 et les prêles (plantes ptéridophytes) peuvent contenir jusqu’à 33% de silicium !
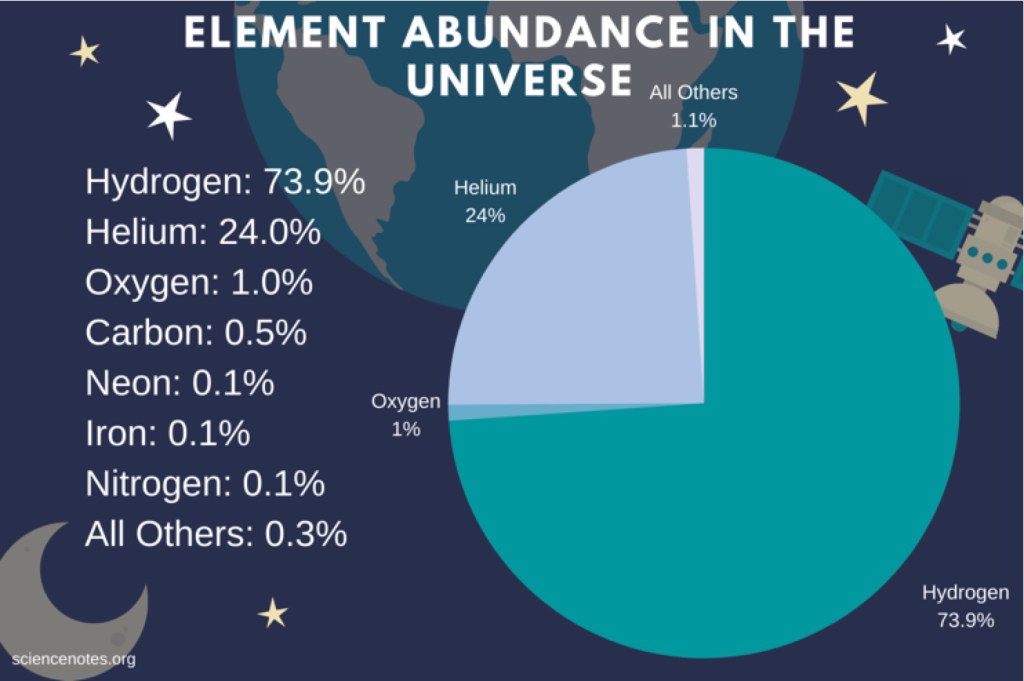
A noter que dans l’Univers, la proportion d’hydrogène est de 74%, d’hélium de 24%, d’oxygène de 1% et de tous les autres éléments réunis du tableau de Mendeleïev de 1% !
La matière organique se distingue du reste de la matière — minérale —, à plusieurs titres : une faible proportion dans l’Univers ; le rôle central joué par le carbone ; une évolution rapide au sein de cycles, notamment dans les écosystèmes où elle passe par des étapes de synthèse et de décomposition.
1.5. Quel est le rôle de l’eau dans les mécanismes vitaux ?
Sur Terre, la vie est toujours associée à l’eau. De plus, on considère généralement que, pour que la vie soit possible sur d’autres planètes, la présence d’eau liquide est indispensable16. Ceci n’est toutefois pas un dogme, certaines approches expérimentales de chimie prébiotique suggèrent que d’autres formes de vie pourraient exister sans eau17. La xénobiologie18 est l’étude des formes de vie crées par la biologie de synthèse. L’eau (formule chimique H2O) est la molécule la plus abondante du vivant, sa proportion dans les organismes en activité physiologique va de 60% à 95%. Ce pourcentage important vient du fait qu’à l’origine, la vie se situe en milieu aquatique et que celle-ci est restée confinée dans les océans pendant environ 3,6 Ga ! Nous verrons plus loin les raisons de ce rôle important.
Remarque importante
« L’eau est au cœur du développement durable. Elle soutient tous les aspects de la vie sur Terre, et l’accès à une eau salubre et propre est un droit humain fondamental. Cependant, des décennies de mauvaise gestion et d’utilisation abusive ont intensifié le stress hydrique, menaçant les nombreux aspects de la vie qui dépendent de cette ressource cruciale. » La Conférence des Nations Unies sur l’eau, qui s’est tenue au siège de l’ONU à New York du 22 au 24 mars 2023, est saluée comme une occasion unique d’accélérer les progrès vers l’accès universel à l’eau potable et à l’assainissement d’ici à 2030. 19
1.6. D’où vient l’eau ?
Dans l’état actuelles des connaissances, il semble de plus en plus certain que l’eau provient principalement du dégazage de l’intérieur de la Terre au moment de sa formation il y a -4,55 Ga20. Quant à un éventuel apport cométaire lors du Grand Bombardement Tardif (-4,1 – -3,1Ga), il serait relativement minime (~ 15%). En effet, suite à la mission Rosetta, au cours de laquelle des chercheurs ont mesuré le rapport isotopique deutérium/hydrogène (D/H), c’est à dire le rapport eau lourde (D2O)/eau légère (H2O), dans la comète 67P/Churyumov-Gerasimenko21, il est apparu que ce rapport ne correspondait pas à celui de l’eau terrestre.
1.7. Une (très) brève histoire des océans (d’après Marc Henry22).
Après la formation d’une croûte solide de composition basaltique, la surface de la Terre continua à se refroidir rapidement, permettant la condensation de la vapeur d’eau. Ceci provoqua un véritable déluge universel avec des pluies soutenues qui en moins d’un millier d’années aboutit à la formation des océans terrestres. La présence d’eau liquide stable à relativement basse température vers -4,40 – -4,35 Ga, comme le suggère la composition isotopique des zircons, indique que le refroidissement de la Terre fut un processus rapide. Des températures inférieures à environ 330°C ont très probablement été atteintes 50-150 Ma après la formation de la Terre. Ces océans néoformés étaient bien sûr trop chauds pour autoriser le développement de la vie. D’après nos connaissances sur les organismes extrêmophiles, la température maximale de survie des « hyperthermophiles », organismes qui aiment les eaux bouillantes, est comprise entre 80 et 110°C. Cela signifie qu’à une époque comprise entre – 4,3 et -4,2 Ga, les océans étaient formés et suffisamment froids pour assurer la survie des premières communautés vivantes, très probablement sous la forme d’hyperthermophiles. Il est toutefois fort probable que la température des océans ne fut pas très stable durant cette période en raison des impacts successifs d’astéroïdes et de comètes qui ont très bien pu augmenter la température localement au-delà de 110°C, voire plus (> 300°C) provoquant l’évaporation partielle des océans et leur re-condensation. Les océans sont donc vraiment devenus stables que vers la fin de l’Hadéen, soit il y a 3,9 Ga, quand le bombardement météoritique massif de la Terre pris fin. Ce n’est qu’à partir de ce moment-là qu’une véritable chimie océanique a pu se mettre en place.
Zircons23 are forever !
La résistance extraordinaire des zircons (silicates de zirconium, ZrSiO4) en fait les seuls minéraux susceptibles de rester stables sur de très longues échelles de temps (plusieurs Ga) et ainsi être un minéral très utile en géochronologie. C’est grâce à des techniques de datation isotopique de l’oxygène contenu dans ZrSiO4 que l’on a pu estimer l’apparition d’eau liquide sur terre. Il est vraisemblable que l’eau liquide existait sur la surface de la Terre il y a plus de 4 Ga. C’est l’étude de cristaux de zircon qui a permis cette découverte. Ces cristaux se sont formés au cours de l’éon Hadéen, une période qui s’étale sur 500 Ma, de 4,5 à 4 Ga. A noter que le volume d’eau dans l’hydrosphère n’a pratiquement plus varié depuis la fin de l’éon Archéen (2,5 Ga). 24
1.8. Pourquoi l’eau a-t-elle une place si importante ?
Cela est dû à ses propriétés physicochimiques qui facilitent les réactions intervenant dans le métabolisme. Pour une description précise et complète de ces propriétés, il est souhaitable de se référer à un cours de chimie. Voici, en résumé, ses propriétés principales :
- Un liquide mobile : mis à part le mercure, l’eau possède la tension superficielle la plus élevée (72 mN.m-1 à 20 °C), ce qui lui confère des propriétés capillaires particulièrement importantes, intervenant -entre autres- dans le mouvement de la sève dans les arbres.
- Un solvant très puissant : l’eau est le solvant naturel le plus efficace. L’eau est capable de dissoudre quasiment n’importe quel substrat. Les eaux de pluies, pourtant issues essentiellement de l’évaporation de l’eau de mer, donc douces, se chargent de minéraux dans l’atmosphère. Leur teneur totale en sels dissous voisine les 7 g.m-3. Quand les pluies ruissellent ou s’infiltrent dans le sous-sol, leurs eaux se chargent de tous les minéraux ou de toutes les matières organiques qu’elles rencontrent. C’est ainsi qu’en moyenne, les eaux de rivières ont une charge en sels dissous de l’ordre de 120 g.m-3.
Ce sont ces eaux qui sont principalement à l’origine de la salinité des eaux de mer, laquelle est de l’ordre de 35.000 g.m-3, soit près de 300 fois plus que les eaux douces.
La plupart de ces minéraux et substances organiques dissous sont des nutriments ou des oligoéléments indispensables à la vie. - Une capacité thermique massique (chaleur spécifique) élevée : l’eau liquide est une des substances dont la chaleur spécifique est la plus élevée (4,2026 kJ.kg−1.K−1 ) à 20 °C.
La chaleur spécifique étant la quantité d’énergie qu’il faut fournir à une masse d’eau donnée pour élever sa température de 1°C, cela revient à dire que l’eau est thermiquement stable, ce qui est favorable à l’homéostasie. En outre, les océans sont de bons accumulateurs de chaleur. - Une enthalpie de fusion et de vaporisation (chaleur latente de fusion et de vaporisation) élevées : les chaleurs latentes de fusion et de vaporisation (enthalpie de changement d’état) représentent les quantités de chaleur qu’il faut fournir pour changer d’état. Pour la vaporisation, il faut fournir 2.454,3 kJ.kg-1 à 20 °C (la plus élevée de tous les liquides). L’énergie nécessaire est prélevée sur le substrat, cela revient à dire, par exemple, que si la majeure partie de la vapeur d’eau atmosphérique vient de l’océan, celui-ci est constamment refroidi par ce mécanisme de vaporisation.
Ces deux dernières caractéristiques expliquent en grande partie pourquoi les hydrosystèmes, surtout océaniques, mais aussi continentaux, se comportent comme de formidables tampons thermiques. - Une transparence seulement dans le spectre visible : si l’eau apparaît incolore, c’est parce qu’elle est transparente dans le spectre visible. Les grandes masses d’eau absorbent les infrarouges sur quelques mètres d’épaisseur. C’est la raison essentielle qui fait que seules les couches les plus superficielles des eaux s’échauffent. Il en va de même pour la vapeur d’eau atmosphérique laquelle limite largement la pénétration des infrarouges. Les eaux ne sont transparentes aux radiations utiles pour la photosynthèse (utilisée par le phytoplancton) que sur une épaisseur qui varie, en moyenne, de 10 à 50 mètres (zone euphotique).
- Une constante diélectrique élevée : la constante diélectrique élevée de l’eau (εr = 78,5 à 25°C) explique pourquoi les substances qu’elle dissout facilement se retrouvent fréquemment sous forme d’ions, facilement assimilables par les organismes vivants. Très rares sont les liquides qui ont des constantes diélectriques plus élevées que celle de l’eau et donc des pouvoirs dissociants supérieurs.
- Une molécule particulièrement stable :
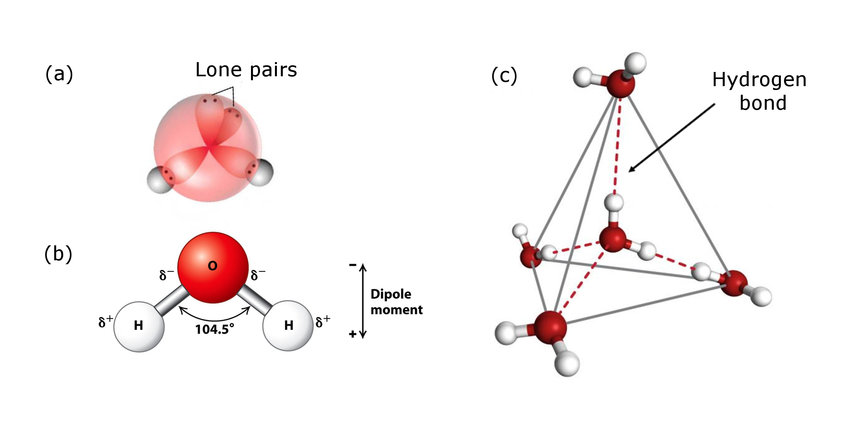
La molécule d’eau25 est particulièrement stable pour la raison que les atomes d’hydrogène et l’atome d’oxygène qui la constituent mettent chacun en commun un électron pour établir leur liaison. De fait, les atomes d’hydrogène possèdent deux électrons et celui d’oxygène possède huit électrons sur sa couche périphérique. C’est cette saturation de la couche externe de la molécule qui lui confère sa grande stabilité (a).
Même si la couche électronique externe reste saturée, les électrons ont tendance à migrer vers l’oxygène (O2δ-) délaissant l’hydrogène (Hδ+). Ceci est dû à la différence d’électronégativité existant entre l’oxygène et l’hydrogène. Cette disponibilité électronique potentielle rend la molécule d’eau très affine pour de multiples substances qu’elle peut ainsi dissoudre (b).
Le déséquilibre électronique a pour effet de rendre possible des liaisons entre l’atome d’hydrogène d’une molécule avec l’atome d’oxygène d’une autre molécule (liaison hydrogène26) (c). En réalité, une molécule d’eau s’entoure de quatre autres molécules constituant un tétraèdre dont les atomes d’oxygène occuperaient les sommets (voir ci-contre). Beaucoup de biomolécules -dont l’ADN et les protéines- font intervenir ces liaisons hydrogène.
Notes et Références
- Le terme « physique » vient du grec η φυσιkη (ê physikê) adopté dans le monde gréco-romain, signifiant « connaissance de la nature ». La physique est la science qui tente de comprendre, de modéliser, voire d’expliquer les phénomènes naturels de l’univers. Elle correspond à l’étude du monde qui nous entoure sous toutes ses formes, des lois de sa variation et de son évolution. (Wikipedia)
- Homéostasie : l’homéostasie est un phénomène par lequel un facteur clé est maintenu autour d’une valeur bénéfique pour le système considéré, grâce à un processus de régulation. (Wikipedia)
- Entropie : le terme entropie a été introduit en 1865 par le physicien allemand Rudolf Clausius (1822-1888) à partir d’un mot grec signifiant « transformation ». Il caractérise le degré de désorganisation, ou d’imprédictibilité du contenu en information d’un système. (Wikipedia)
- https://fr.wikipedia.org/wiki/Vie
- Cleland, Carol E.; Chyba, Christopher F., Origins of Life and Evolution of the Biosphere, v. 32, Issue 4, p. 387-393 (2002). Texte traduit par DeepL.
- A new view of the tree of life. Nature Microbiology Volume 1, Article number: 16048 (2016). https://www.nature.com/articles/nmicrobiol201648
- Ce sont des êtres vivants dont les organismes unicellulaires ou les cellules ciliées des organismes pluricellulaires sont propulsées par un flagelle unique, et non tractées (par opposition aux « Anterokonta »).
- https://www.lemonde.fr/planete/article/2011/10/10/le-genome-du-plus-gros-virus-jamais-decouvert-a-ete-sequence_1585389_3244.html
- Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon. Bell et al. Proceedings of the National Academy of Sciences of the United States of America. 2015, vol. 112 no. 47, 14518–14521.
- Evidence for early life in Earth’s oldest hydrothermal vent precipitates. Matthew S. Dodd et al. Nature,volume 543, pages 60–64 (02 March 2017). 10a . https://www.vice.com/en/article/z3mmme/scientists-discover-ancient-lost-world-that-rewrites-history-of-life-on-earth
- Pour la Science n°469-Novembre 2016
- Par définition, les éléments synthétiques sont absents du milieu naturel terrestre. Depuis la découverte de la fission nucléaire en 1938, on a produit artificiellement 26 éléments et des centaines d’isotopes.
- https://sciencenotes.org/elements-in-the-human-body-and-what-they-do/
- https://fr.wikipedia.org/wiki/Hexactinellida
- https://cordis.europa.eu/article/id/31381-research-shows-diatomic-ability-to-process-silicon/fr
- On the probability of habitable planets. Forget, F. International Journal of Astrobiology. Volume 12, Issue 3 (The Drake Equation). July 2013, pp. 177-185, Cambridge University Press.
- Simulation suggests non-water-based life could exist on Saturn’s moon Titan.July 5, 2016 by Bob Yirka, Phys.org.
- La xénobiologie est l’étude des formes de vie crées par la biologie de synthèse. « De ces molécules étranges […] émergeront peut-être des créatures inédites, comme cela s’est produit il y a 3 Ga sur notre planète ». M.-C. Maurel, M. Cassé. Xénobiologie. Vers d’autres vies. 2018, Odile Jacob Sciences.
- https://news.un.org/fr/story/2023/03/1133382
- Daniele L. Pinti (2005), « The Origin and Evolution of the Oceans », Lectures in Astrobiology, Vol. 1. M. Gargaud, B. Barbier, H. Martin & J. Reisse Eds, Springer-Verlag, New York, Berlin, p.83-112.
- Rosetta results: Comets did not bring water to Earth. By Rebecca Morelle, Science Correspondent, BBC News 10 December 2014. Article original : https://science.sciencemag.org/content/347/6220/1261952
- https://marchenry.org/tag/oceans/ citant Daniele L. Pinti (2005), « The Origin and Evolution of the Oceans », Lectures in Astrobiology, Vol. 1. M. Gargaud, B. Barbier, H. Martin & J. Reisse Eds, Springer-Verlag, New York, Berlin, p.83-112.
- https://www.futura-sciences.com/sciences/definitions/chimie-zircon-4668/
- Isotope composition and volume of Earth’s early oceans.Emily C. Pope, et al. PNAS, March 20, 2012 109 (12) 4371-4376
- https://fr.wikipedia.org/wiki/Mol%C3%A9cule_d%27eau
- https://fr.wikipedia.org/wiki/Liaison_hydrog%C3%A8ne
