2.1. Introduction
L’objectif pédagogique est d’étudier les caractéristiques de différentes eaux dans le but de :
- faire connaître le rôle d’une substance omniprésente dans les écosystèmes.
- montrer qu’un produit si banal peut en réalité s’avérer complexe.
- réaliser que l’eau est un matériel didactique très simple pour « redécouvrir » certaines notions de chimie et de biologie.
- aborder brièvement des notions de technologie par exemple en aquaculture/aquariophilie, en contrôle qualité des eaux de boisson et en ingénierie du traitement des eaux.
- Déterminer les relations qui existent entre les unités de mesure utilisées dans ces domaines, qui ne sont pas harmonisées.
Remarque
Afin de rester dans le cadre des objectifs de RECYCLABS, il est possible d’étudier de manière assez précise les eaux douces et l’eau de mer. L’eau dite « potable » est liée à la consommation humaine et fait l’objet de normes de qualité très strictes. L’OMS (entre autres) publie ces normes qui concernent des critères spécifiques liés à la santé humaine (pollutions par des substances toxiques, contaminations par des agents pathogènes, etc.)1. Étant donné le nombre très élevé de paramètres à évaluer et l’utilisation d’appareils coûteux, l’étude d’une eau de boisson sera abordée mais sans atteindre le niveau de complexité imposé par les normes.
On se propose d’étudier 4 eaux :
- de boisson
- de rivière
- de distribution
- de l’eau de mer
Le cas particulier de l’eau « pure »
La pureté de l’eau, plus exactement sa minéralisation, peut être mesurée par sa conductivité électrique (voir annexe 1). L’eau pure n’est pas un bon conducteur d’électricité. L’eau distillée ordinaire, en équilibre avec le dioxyde de carbone (CO2) de l’air, a déjà une conductivité mesurable. Du fait que le courant électrique est transporté par les ions de la solution, la conductivité augmente lorsque la concentration ionique augmente (Loi de Kohlrausch, voir annexe 1). Voici quelques exemples de conductivité d’eaux de différentes origines :
- Eau à usage pharmaceutique : ≤ 1,3 μS.cm-1
- Eau distillée : 0,5 – 2 μS.cm-1
- Eau déminéralisée : 2 – 10 μS.cm-1
- Eau courante : 500 – 800 μS.cm-1
- Eau potable : < 1055 μS.cm-1
- Eau de mer : 40 – 60 mS.cm-1
L’eau pure existe-t-elle ?
Si, en théorie, l’eau chimiquement pure existe, en pratique, il est très difficile de l’isoler. En effet, si l’eau (liquide) est pure, les seules espèces chimiques présentes dans le milieu aqueux sont H2O, le cation oxonium H3O+ (ou le proton H+) et l’anion hydroxyde OH– (noté plus précisément HO–) (voir annexe 1). Ces deux ions proviennent de l’autoprotolyse de l’eau :
2 H2O(l) ⇋ H3O+(aq) + OH–(aq)
Or, ce n’est pratiquement jamais le cas car l’eau étant un solvant très puissant, elle contient toujours des traces d’autres ions en solution (électrolytes), dont ceux formés par la solvatation2 du CO2 atmosphérique.
2.2. Que va-t-on étudier et pourquoi ?
2.2.1. Le pH (voir annexe 2) et l’alcalinité
pH et problèmes environnementaux
Ces dernières années, les médias ont fait état de deux phénomènes apparus à la suite des activités industrielles et humaines. Ceux-ci sont directement liés à la notion de pH : il s’agit des pluies acides et de l’acidification des océans. L’impact de ces deux « nuisances » est complexe car elle met en jeu beaucoup de facteurs. Pour simplifier, en ce qui concerne les pluies acides, elle est due au dégagement dans l’atmosphère de différents gaz (SO2, NOx, …) et de particules susceptibles de réagir avec l’eau atmosphérique et de produire des espèces chimiques faisant baisser le pH des précipitations à un niveau inférieur à 5.
En ce qui concerne l’acidification des océans, il s’agit principalement de la conséquence de la rupture de l’équilibre entre la concentration de CO2 atmosphérique3 et de celle des ions (hydrogéno)carbonate de calcium dans les océans (équilibre carbocalcique). Normalement, le pH de l’eau de mer est de 8,25, en 2010 il se situait aux alentours de 8,07 (diminution d’environ 2,2%). Cette faible baisse est cependant suffisante pour perturber fortement la biodiversité du milieu marin. Un réseau international de surveillance4 a été créé afin de quantifier et éventuellement de limiter ce phénomène.
Définitions
a) Définition de base
On entend par alcalinité d’une eau sa capacité à neutraliser les acides, en raison des bases dissoutes. Elle est ainsi une mesure de l’effet tampon5 de l’eau concernée. L’alcalinité de la plupart des eaux est produite principalement par les anions carbonates (CO32-), hydrogénocarbonates (HCO3–) et hydroxyde (OH–) dissous.
L’alcalinité d’un échantillon d’eau est déterminée par titrage avec un acide fort (H3O+) jusqu’à obtenir des valeurs de pH définies.
On définit6 :
- La consommation d’acide correspondante exprimée en mmol.L-1 de H3O+ jusqu’à pH 8,2 :
Capacité pour acides jusqu’à pH 8,2 ( KS8,2) - La consommation d’acide correspondante exprimée en mmol.L-1 de H3O+ jusqu’à pH 4,3 :
Capacité pour acides jusqu’à pH 4,3 (KS4,3)
b) Le degré français °f traduit de manière « technique » cette « capacité pour acides ».
Le Titre Alcalimétrique (simple) (TA) : est le volume d’acide fort (exprimé en mL) à 20 mmol.L-1 en ions H3O+ nécessaire pour titrer 100 mL d’eau en présence de phénolphtaléine.
Le Titre Alcalimétrique complet (TAC) est le volume d’acide fort (exprimé en mL) à 20 mmol.L-1 en ions H3O+ nécessaire pour titrer 100 mL d’eau en présence de méthylorange (ou de vert de bromocrésol).
| Indicateur coloré | Teinte acide | pH zone de virage (teinte sensible) | Teinte basique | Permet d’évaluer | |
|---|---|---|---|---|---|
| Phénolphtaléine | Incolore | 8,2 Rose 9,9 | Violet | Le TA: [CO32-] + [OH–] | KS8,2 |
| Méthyl Orange (MO) | Rouge | 3,1 Orange 4,3 | Jaune | Le TAC : [CO32-] + [OH–] + [HCO3–] | KS4,3 |
| Vert de Bromocrésol (VB) | Jaune | 3,6 Vert 5,4 ≈ 4,3 | Bleu | ||
c) Il existe d’autres définitions de ces paramètres selon le pays, ce qui prête souvent à confusion.
Ainsi, en Europe, il existe aussi les degrés allemands (°d) relatifs à la « dureté carbonatée » ou « Karbonat Härte (KH), et les degrés anglais (°e). Aux USA, il existe encore d’autres unités !
Problème : pour les degrés allemands et anglais, les unités se réfèrent aux composés du calcium (Ca) :
CaO : 1°d (KH) = 10 mg.L-1 de CaO
CaCO3 : 1°e = 1 grain de carbonate de calcium par gallon GB (65 mg / 4,55 L) soit 14,25 mg.L-1 de CaCO3
Pour les facteurs de conversion, voir explications plus loin.
Remarque
Excepté dans l’eau de mer (et certaines eaux industrielles), le pH des eaux naturelles est en général inférieur à 8,27; le KS8,2 est donc nul et on ne tient compte que du KS4,3.
Comment évaluer l’alcalinité8 ?
Le détail de la manipulation est repris dans les protocoles expérimentaux.
A quoi correspond chimiquement le point d’équivalence ?
A l’équivalence, les cations oxonium (H3O+), présents dans la solution d’acide fort (le titrant, HCl 20 mmol.L-1) et les anions antagonistes présents dans la solution titrée (eau à analyser) ont été introduits en proportions stœchiométriques9.
En supposant que les anions antagonistes sont principalement OH–, HCO3– et CO32-, nous obtenons, en utilisant la formule C1Veau = C2Véq avec :
C1 = somme des concentrations en hydroxyde et carbonates
Veau = volume d’eau à analyser (100 mL)
C2 = concentration en H3O+ du titrant (20 mmol.L-1)
Véq = volume utilisé pour le titrage jusqu’au point d’équivalence
Les proportions stœchiométriques sont les suivantes :
| OH– + H3O+ → 2H2O x mol x mol | x mol = [OH–] Veau |
| CO32- + 2H3O+ → CO2(aq) + 3H2O y mol 2y mol | y mol = [CO32-] Veau |
| HCO3– + H3O+ → CO2(aq) + 2H2O (a) z mol z mol | z mol =[HCO3–] Veau |
| x + 2y + z = Véq x [H3O+] = ([OH–] + 2[CO32-] + [HCO3–]) Veau | |
Veau x ([OH–] + 2[CO32-] + [HCO3–]) = Véq x [H3O+]
Les volumes et les concentrations sont normalement exprimées en litres et mol.L-1 mais si on les exprime en mL et en millimol.L-1, la relation reste inchangée.
Il vient:
Soit:
Si on en revient à la définition du degré français, le Véq donne le TAC (°f), on a donc :
Puisque le KS8,2 (TA) est nul (dans la majorité des cas), les ions carbonates sont absents et la concentration en ions hydroxyde est négligeable car : pOH = 14 – pH = 14 – 4,3 = 9,7 → [OH–] = 10-9,7 mol.L-1.
On peut donc faire l’approximation suivante :
Or, la capacité pour acides jusqu’à pH 4,3 (KS4,3) est la consommation d’acide correspondante en mmol.L-1 de H3O+. A pH 4,3 on est au voisinage du point d’équivalence lors du titrage des ions hydrogénocarbonates dans l’échantillon d’eau, on peut donc évaluer la [HCO3–] présente dans l’échantillon puisque l’ion hydrogénocarbonate HCO3– réagit avec H3O+ de manière stœchiométrique :
HCO3– + H3O+ → H2CO3 + H2O
et
[HCO3–] = [H3O+] = KS4,3 exprimés en mmol.L-1
et
5 KS4,3 = TAC (°f) ou KS4,3 = 0,2 TAC (°f)
En qualité des eaux de boisson, on utilise les mg.L-1 pour quantifier les espèces chimiques.
La masse molaire de HCO3– étant de 61 g.mol-1 on a :
[HCO3–] en mg.L-1 = [HCO3–] en mmol.L-1 x 61.
1 unité de TAC exprimée en °f correspond à 0,2 x 61 = 12,2 mg.L-1 de HCO3–
Résultats
Le tableau suivant regroupe les valeurs de Véq (mL) obtenues pour les différentes eaux selon les méthodes par indicateurs colorés et par pHmétrie.
| Eau | Méthyl Orange | Vert Bromocrésol | pHmétrie | Moyenne (mL) |
| Véq | Véq | Véq à pH 4,3 | ||
| Distribution | 17,3 | 17,5 | 16,2 | 17,0 |
| Evian | 28,1 | 27,8 | 28,9 | 28,3 |
| Muga | 21,5 | 20,2 | 21,8 | 21,2 |
| Mer | 15,0 | 14,5 | 12,7 | 14,1 |
Reprenons les valeurs des moyennes du Tableau 3 et calculons le TAC, la KS4,3 et le KH (°d).
Puisque Véq = TAC (°f), on obtient les résultats finaux :
| Eau | Moyenne (mL) | TAC (°f) | KS4,3 | KH (°d)* |
| Distribution | 17,0 | 17 | 3,4 | 9,7 |
| Evian | 28,3 | 28,3 | 5,7 | 16,1 |
| Muga | 21,2 | 21,2 | 4,2 | 12,1 |
| Mer | 14,1 | 14,1 | 2,8 | 8 |
* Voir ci-dessous Cas particulier : aquariophilie et pisciculture
La masse molaire de HCO3– étant de 61 g.mol-1 on a :
[HCO3–] en mg.L-1 = [HCO3–] en mmol.L-1 x 61 = KS4,3 x 61; soit pour les eaux analysées:
| Eau | [HCO3–] en mg.L-1 | |
| Valeurs mesurées | Valeurs annoncées | |
| Distribution | 207 | 159a |
| Evian | 348 | 360b |
| Muga | 256 | – |
| Mer | 171 | 174c |
a Valeur moyenne en Espagne
b Étiquette bouteille
c mrrecifcaptif.fr
Cas particulier : aquariophilie et pisciculture
En aquariophilie et en pisciculture, l’usage a consacré l’expression des duretés en degrés allemands (KH (d°) tests en bandelettes). Ceci peut prêter à confusion étant donné que les définitions ne se référent pas à la même espèce chimique. Pour rester « chimiquement correct » il convient d’uniformiser les unités.
Méthode:
1) On ramène tout d’abord les valeurs annoncées en °d en mmol.L-1, quitte à retransformer ensuite les valeurs en mg.L-1.
2) La définition de base du °d (KH) est : 1°d = 10 mg.L-1 d’oxyde de calcium (CaO) or, le KH, exprimé lui aussi en °d, concerne l’ion hydrogénocarbonate HCO3–; il faut donc trouver une correspondance.
Exprimé en mmol.L-1, 1°d = 0,178 mmol.L-1 de CaO (masse molaire : 56,1 g.mol-1)
Or, il faut 2 ions HCO3– pour se combiner au calcium pour former Ca(HCO3)2. On considère donc que, d’une manière équivalente :
1°d KH = 0,178 x 2 = 0,356 mmol.L-1 de HCO3–, soit 21,78 mg.L-1 de HCO3–
3) Conversion des °d KH en °f TAC :
1 mg.L-1 HCO3– = 0,046 °d KH = 0,016 mmol.L-1 de HCO3– = 0,080 °f TAC,
car 5[HCO3–] = TAC (°f) avec [HCO3–] exprimé en mmol.L-1 .
Donc 1°d KH = 0,080 / 0,046 °f TAC
1°d KH = 1,74 °f TAC
1°f TAC = 0,57 °d KH
4) Cas du degré anglais
1°e = 1 grain de carbonate de calcium par gallon GB (65 mg / 4,55 L) soit 14,25 mg.L-1 de CaCO3.
La masse molaire de CaCO3 = 100 g.mole-1, on effectue le même raisonnement que pour le d° KH:
1 mmol.l-1 de CaCO3 = 100 mg.L-1 de CaCO3 ⇒ 1 mg.L-1 de CaCO3 = 0,01 mmol.L-1 de CaCO3.
Or, l’alcalinité concerne l’ion HCO3– et il faut 2 ions HCO3– pour se combiner au Ca pour former Ca(HCO3)2.
On considère donc que, d’une manière équivalente : 0,01 mmol.L-1 de CaCO3 ⇔ 0,02 mmol.L-1 de Ca(HCO3)2 soit 1,22 mg.L-1 de HCO3–.
1°e = 14,25 x 1,22 = 17,38 mg.L-1 de HCO3–
Tableau récapitulatif des facteurs de conversion
| On cherche → | 1 mmol.l-1 HCO3– (KS4,3) | 1 mg.L-1 de HCO3– | °f | °d | °e |
| On donne ↓ | Facteur de conversion | ||||
| 1 mmol.L-1 HCO3– (KS4,3) | 1 | 61 | 5 | ||
| 1 mg.L-1 de HCO3– | 0,016 | 1 | 0,082 | 0,046 | 0,058 |
| 1 °f | 0,2 | 12,2 | 1 | 0,57 | 0,69 |
| 1 °d | 0,356 | 21,78 | 1,74 | 1 | 1,25 |
| 1 °e | 0,285 | 17,38 | 1,46 | 0,8 | 1 |
2.2.2. La dureté : le calcium et le magnésium
Définitions
La dureté de l’eau ou Titre Hydrotimétrique (TH) est un indicateur de la minéralisation10 de l’eau due aux ions alcalino-terreux calcium et magnésium (Ca2+ et Mg2+). Il est d’usage de ne rapporter l’indication de la dureté de l’eau que sur le calcium, c’est-à-dire d’exprimer la teneur en Mg 2+ comme teneur en Ca2+ 11. Comme dans le cas de l’alcalinité, il existe plusieurs définitions et unités de dureté suivant le pays concerné. Le baryum et le strontium sont aussi des métaux alcalino-terreux mais, étant présents à l’état de traces dans les eaux douces naturelles, leur teneur n’est pas prise en compte dans les calculs de la dureté.
On distingue trois types de dureté :
- la dureté totale = le titre hydrotimétrique (TH)
- la dureté permanente est la partie des ions dureté pour laquelle il existe une quantité équivalente d’anions chlorures, sulfates, nitrates, phosphates … Elle se détermine sur de l’eau ayant subi une ébullition prolongée, ce qui a pour effet de provoquer la précipitation des carbonates de Ca et Mg (mais pas des autres sels de Ca et Mg).
- la dureté temporaire = « la dureté carbonatée » = le titre alcalimétrique complet (TAC). C’est la partie des ions dureté pour laquelle il existe une quantité équivalente d’anions de l’acide carbonique (CO32- et HCO3–)
La dureté totale = la dureté permanente + la dureté temporaire
Remarque
En général, on ne mesure pas la dureté de l’eau de mer étant donné que les teneurs en calcium et magnésium y sont constantes : 413 mg.L-1 et 1290 mg.L-1 respectivement (voir section 2.2.6.). En aquariophilie/aquaculture marine, on les dose séparément à l’aide de « kits ». Nous verrons s’il est possible de retrouver ces valeurs au moyen de la technique décrite plus loin.
Unités
Le titre hydrotimétrique/degré français (TH °f) correspond à une concentration en ions Ca2+ + Mg2+ égale à 10-1 mmol.L-1.
A partir de cette définition, comme dans le cas de l’alcalinité, on peut faire différentes conversions :
1) On calcule toutes les unités par rapport au calcium (Ca2+) ou à ses combinaisons suivantes : oxyde (CaO) ou carbonate (CaCO3)
2) On utilise soit les mmol.L-1, soit les mg.L -1 (ppm)
3) Selon le pays, on considère l’une ou l’autre espèce chimique et unité. Soit °d : degré allemand pour GH (Gesamthärte) et °e : degré anglais. Le tableau suivant résume ces particularités :
| mmol.L-1 | mg.L-1 | |
|---|---|---|
| Ca++ | °TH/°f | – |
| CaO | – | °d |
| CaCO3 | – | °e |
4) Afin de calculer les facteurs de conversion, il faut connaitre les masses atomiques/moléculaires des différents composés et leur correspondance mmol.L-1 ↔ mg.L-1, sachant que 1 mmole de Ca2+ est équivalente à 1 mmole de CaO et à 1 mmole de CaCO3:
| g.mol-1 | mmol.L-1 | mg.L-1 | |
|---|---|---|---|
| Ca++ | 40,1 | 1 | 40,1 |
| CaO | 56,1 | 1 | 56,1 |
| CaCO3 | 100,1 | 1 | 100,1 |
5) Les définitions deviennent les suivantes, exprimées en mg.l -1:
| mg.L-1 | ||
|---|---|---|
| Définition de base | Équivalence en CaCO3 | |
| 1 °f | 4,01 de Ca++ | 10,01 de CaCO3 |
| 1 °d | 10 de CaO | 17,84 de CaCO3 |
| 1 °e | 14,25 de CaCO3 | 14,25 de CaCO3 |
6) En effectuant les rapports entre les équivalences en CaCO3, on obtient les facteurs de conversion suivants12 :
| On cherche → | °f | °d | °e |
| On donne ↓ | Facteur de conversion | ||
| °f | 1 | 0,56 | 0,71 |
| °d | 1,78 | 1 | 1,25 |
| °e | 1,42 | 0,8 | 1 |
Remarque
Ces valeurs sont fort semblables à celles obtenues en se basant sur les correspondances en HCO3– (voir tableau 6).
7) Traductions :
| Français | Dureté totale | Durée temporaire | Durée permanente |
| Allemand | Gesamthärte (GH) | Karbonathärte » (KH) | Nichtkarbonathärte (NKH) |
| Anglais | Total hardness | Temporary hardness | Permanent hardness |
Que signifient ces valeurs dans la réalité ?
Parmi les eaux naturelles, y compris les eaux de distribution et de boisson, on distingue, selon le TH (°f) :
| Plage de valeurs du titre hydrotimétrique | |||||
|---|---|---|---|---|---|
| TH (°f) | 0 à 7 | 7 à 15 | 15 à 30 | 30 à 40 | + 40 |
| Eau | très douce | douce | plutôt dure | dure | très dure |
Une eau dure présente des inconvénients d’ordre domestique en raison de la précipitation du calcaire (CaCO3). On peut éviter la formation de tartre en éliminant le calcium par adoucissement de l’eau ou osmose inverse.
En outre, le calcaire diminue l’efficacité des détergents. Les doses conseillées sur le mode d’emploi des lessives sont valables pour une eau moyennement dure (≈ 15°f) et doivent être augmentées (ou diminuées) si on utilise une eau dure (ou plus douce).
La dureté d’une eau est sans conséquence sur la santé humaine — le calcium et le magnésium sont des constituants majeurs de notre organisme — et une eau demeure potable quel que soit son TH13. En France, l’eau de distribution doit être < 30°TH.
Le titre hydrotimétrique des eaux naturelles augmente souvent avec l’éloignement de la source, l’eau se chargeant en sels minéraux. Les eaux naturelles continentales étant généralement calcaires (bicarbonatées calciques), la valeur de leur TH est voisine de celle de leur titre alcalimétrique complet (TAC ou « dureté carbonatée ») exprimés dans les mêmes unités !
Mode opératoire
Voir : Protocoles expérimentaux
Résultats
1) Dureté totale
Voici les valeurs de VE et de Ceau pour l’eau de distribution, l’eau d’Évian et l’eau de la Muga (fleuve) (moyenne de deux titrages précis). Ces valeurs nous donnent directement le titre hydrotimétrique TH °f :
| Eau | VE (mL) | Ceau (mmol.L-1) | TH °f | GH °d |
|---|---|---|---|---|
| Robinet | 22,0 | 2,2 | 22 | 12,3 |
| Evian | 32,0 | 3,2 | 32 | 17,9 |
| Muga | 31,0 | 3,1 | 31 | 17,4 |
Pour l’eau du robinet et l’eau d’Evian, il est possible de comparer les valeurs obtenues avec celles annoncées ;
celles-ci étant toujours exprimées en mg.L-1.
| Eau | Valeurs annoncées (mg.L-1) | Valeurs annoncées (mmol.L-1) | Ca + Mg (mmol.L-1) | TH °f Valeur calculée | ||
| Ca | Mg | Ca | Mg | |||
| Robinet14 (Valeur moyenne en Espagne) | 52,79 | 17,72 | 1,32 | 0,74 | 2,06 | 20,6 |
| Evian (Etiquette sur la bouteille) | 80 | 26 | 2 | 1,08 | 3,08 | 30,8 |
| Muga (valeurs non disponibles) | – | – | – | – | – | – |
2) Comparaison des différentes valeurs
Résumons les données obtenues en °f pour les trois eaux :
| Eau | TH | TAC | ||
| Annoncé* | Mesuré | Annoncé** | Mesuré | |
| Robinet | 20,6 | 22 | 12,9 | 17 |
| Evian | 30,8 | 32 | 29,2 | 28,3 |
| Muga | – | 31 | – | 21,2 |
* Voir tableau 14
** [HCO3–] en mg.L-1 x 0,081 (1 mg.L-1 de HCO3– correspond à 0,081 °f )
Discussion des résultats
Dans le cas de l’eau d’Évian, l’étiquette indique une concentration en ion hydrogénocarbonate de 360 mg.L-1, l’écart entre la valeur mesurée et la valeur annoncée est donc d’environ 3,3 %.
En Espagne, la teneur moyenne de cet ion dans les eaux de distribution est de 159 mg.L-1 14. L’eau de distribution d’Empuriabrava contient donc environ 30 % d’ion hydrogénocarbonate de plus que la moyenne.
En ce qui concerne les paramètres vérifiables (TH et TAC), les valeurs obtenues expérimentalement concordent relativement bien avec les données. De plus, la relation TH > TAC valable pour les eaux douces naturelles est bien vérifiée, ce qui indique que les cations Ca2+ et Mg2+ sont majoritaires.
2.2.3. Un composé fréquent : l’ion sulfate
La teneur en anions sulfate SO42- est souvent affichée dans la composition des eaux de boisson et de distribution (norme européenne : < 250 mg.L-1)15, toutefois, certaines eaux minérales contiennent plus de 1.000 mg.L-1! Ces eaux possèdent des propriétés laxatives !
Dans l’eau de mer, il s’agit de l’anion le plus abondant (2.700 mg.L-1) après les chlorures. Le soufre (S) contribue au métabolisme des protéines car cet élément entre dans la composition des acides aminés soufrés : méthionine et cystéine. Les acides aminés sont les précurseurs des protéines.
Mode opératoire
Voir : Protocoles expérimentaux
Résultats
Voici les résultats obtenus pour 3 eaux :
- une eau minérale (Evian) nous permettant non seulement d’effectuer un dosage mais aussi une évaluation de la méthode (turbidimétrie)
- une eau de distribution (robinet)
- une eau fluviale (Muga prélevée le 3 avril 2023)
Voici les valeurs obtenues d’après la droite d’étalonnage représentée sur la Fig. 11. des protocoles expérimentaux.
| Eau | [SO42-] mg. L-1 | |
|---|---|---|
| Valeur mesurée | Valeur annoncée (étiquette) | |
| Evian | 24,3 | 15 |
| Robinet | 37 | – |
| Muga | 80,5 | – |
Discussion des résultats
La seule eau permettant d’effectuer une comparaison est l’eau d’Evian. Dans les conditions de l’expérience, on observe une différence de 62% entre la valeur annoncée et la valeur observée. Toutefois, avec un coefficient de corrélation de 0,977 on peut raisonnablement affirmer que la méthode utilisée est acceptable. Notons que pour obtenir un résultat proche de la réalité, il faudrait répéter la manipulation au moins cinq fois et analyser statistiquement les valeurs obtenues.
En ce qui concerne l’eau de distribution, la teneur en sulfates se trouve dans les normes européennes. L’importante concentration en sulfates de la Muga provient vraisemblablement de rejets d’eaux usées car plusieurs produits de consommation contiennent des sulfates. Néanmoins, la valeur mesurée n’est pas toxique pour le milieu aquatique.
2.2.4. L’eutrophisation : les nitrates
L’eutrophisation (du grec ancien : εὖ / eû, « bien », et de τροφή / trophḗ, « nourriture ») est le processus par lequel des nutriments s’accumulent dans un milieu ou un habitat (terrestre ou aquatique). Les causes sont multiples et peuvent donner lieu à des situations d’interactions complexes entre les différents facteurs. Les nutriments concernés sont principalement l’azote (provenant surtout des nitrates agricoles et des eaux usées, ainsi que secondairement de la pollution automobile) et le phosphore (provenant surtout des phosphates agricoles et des eaux usées). L’ensoleillement ou la température de l’eau (qui tend à augmenter avec le réchauffement climatique) peuvent exacerber l’eutrophisation16.
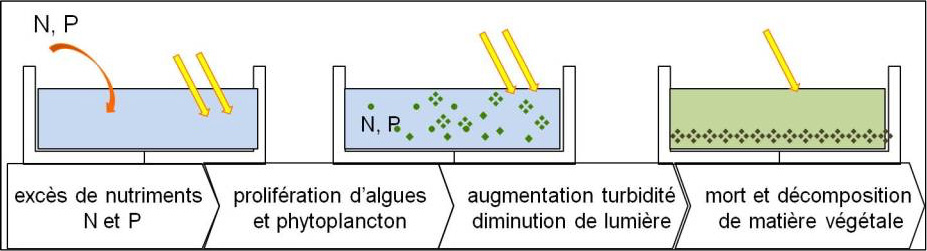
Les nitrates (composés de l’anion NO3–) étant très solubles dans l’eau, il est normal d’en trouver en quantités modérées partout, dans les eaux douces et marines, en surface et dans les nappes. À faible dose, ils sont un nutriment de la plus grande importance pour les plantes, algues et certaines bactéries photosynthétiques et constituent l’une des sources minérales qui leur permet de produire de la matière organique. L’ion nitrate est donc indispensable dans les écosystèmes.
Mais aujourd’hui, du fait de l’apport important de quantités supplémentaires de nitrates par l’agriculture (engrais) et par les rejets urbains ou industriels, les milieux naturellement pauvres en nitrates, auxquels la plupart des écosystèmes sont adaptés, se réduisent considérablement. Même en tenant compte des phénomènes naturels de dénitrification, les eaux à basse teneur en nitrates sont de plus en plus rares, en raison d’un apport par le ruissellement, et parfois par des alimentations par la nappe phréatique17. Dans les pays de l’Union Européenne, la présence de ce composé dans les écosystèmes est réglementée par la « Directive Nitrates »18&19. La limite de nitrates établie par l’OMS est de 50 mg.L-1 pour que l’eau soit considérée comme potable.
Mode opératoire
Voir : Protocoles expérimentaux
Résultats
3 eaux ont été analysées:
Evian, distibution (robinet), et Muga (fleuve).
Seule l’eau minérale (Evian) permet une comparaison.
Il est apparu qu’au niveau du lieu de prélèvement, l’eau de la Muga contenait du NaCl ce qui n’a pas permis de réaliser la mesure. En effet, d’après la méthode utilisée, NaCl fait partie du résidu sec et réagit avec H2SO4 . Quant à l’eau de distribution, la teneur en nitrates étant très faible elle est indécelable par la méthode utilisée ici.
Voici le résultat obtenu pour l’eau d’Evian.
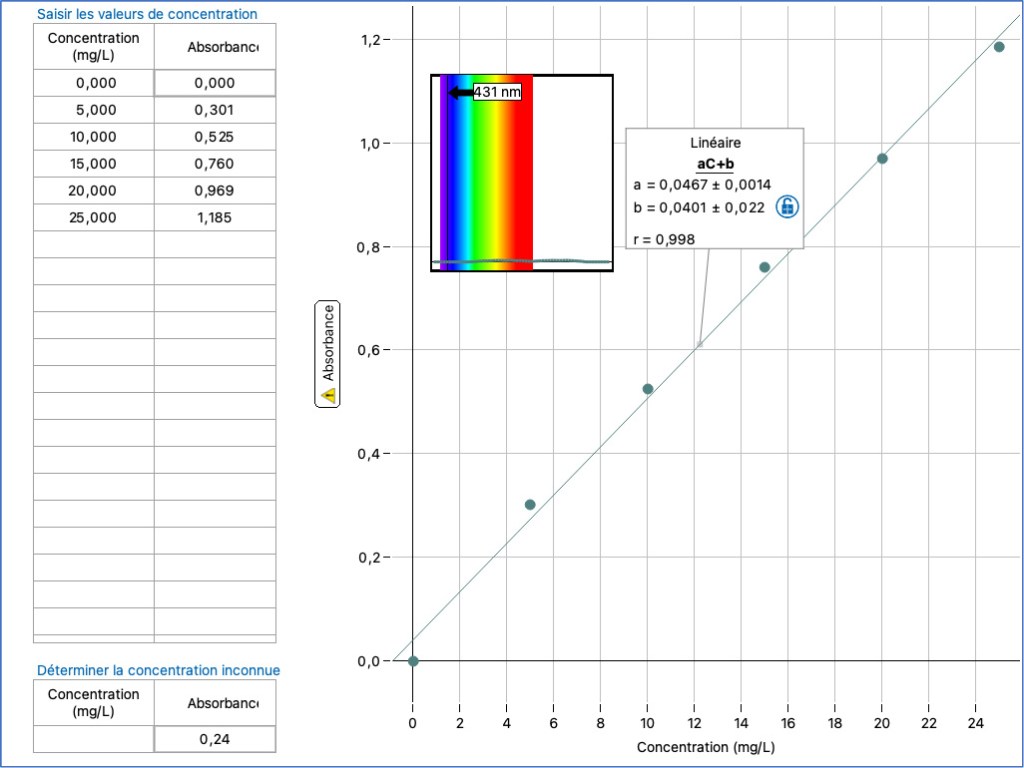
L’équation de la droite de régression s’écrit : A = 0,0467C + 0,0401.
Comme l’absorbance de la concentration inconnue (Evian) est de 0,24, la concentration (C) en NO3– de cette eau est de 4,28 mg.L-1.
Discussion des résultats
L’étiquette de la bouteille indique une concentration de 3,8 mg.L-1, ce qui donne une différence de 0,48 mg.L-1 (12,6%) avec la valeur mesurée, ce qui est tout à fait acceptable dans les conditions de RECYCLABS.
Cette méthode étant sensible, on pourrait affiner celle-ci en construisant une droite d’étalonnage comprise entre 0 et 15 mg.L-1 NO3– par ex.
2.2.5. L’eutrophisation : les phosphates
Sans phosphore, la vie n’est pas possible. Élément fondamental du vivant, il est indispensable aux écosystèmes naturels comme à la production agricole. Les activités humaines (agriculture, eaux usées, expansion urbaine, industries) modifient cependant profondément son cycle. Parmi les conséquences, les écosystèmes aquatiques se dérèglent, des algues prolifèrent puis se décomposent en consommant l’oxygène nécessaire à de nombreuses espèces : c’est ce qu’on appelle l’eutrophisation. Par ailleurs, le phosphore n’est pas une ressource renouvelable. A l’échelle mondiale, les estimations de consommation future prévoient un épuisement des gisements phosphatés d’ici un à deux siècles. Le contrôle des flux de phosphore dans l’environnement s’avère ainsi primordial pour restaurer des milieux dégradés et pour sécuriser la nutrition de l’humanité20.
Dans les pays de l’Union Européenne, l’utilisation des phosphates dans les produits de consommation (détergents textiles et lave-vaisselle) est réglementée21.
La teneur en phosphates n’est pas indiquée sur les étiquettes collées sur les bouteilles d’eaux minérales. En ce qui concerne l’eau de distribution (robinet), la norme à Bruxelles (Belgique) est basée sur le phosphore total qui ne doit pas dépasser 2,185 mg.L-122.
Mode opératoire & Résultats
À la suite de tests préliminaires, il est apparu que le dosage des orthophosphates (ions H2PO4– , HPO42- et PO43-) à de très faibles concentrations (de l’ordre du mg.L-1) ne donnait pas des résultats fiables dans le cadre de RECYCLABS. Pour obtenir des valeurs correctes, il est nécessaire d’utiliser des réactifs spécifiques couteux.
Il est toutefois possible de doser le phosphore inorganique dans des produits qui en contiennent des proportions élevées (engrais par exexemple) par une méthode simple qui est le titrage thermométrique ; celle-ci sera exposée dans la section « Nouvelles expériences intéressantes« .
2.2.6. La salinité de l’eau de mer et le sel marin.
Introduction (un peu d’histoire)23
C’est le père de la chimie « moderne » Antoine Lavoisier qui, en 1776, étudia la composition de l’eau de mer. Plus tard, en 1819, le chimiste suisse Alexandre Marcet, énonce un principe qui sera vérifié en 1884 par le chimiste allemand William Dittmar. Ce principe, formulé sous le nom de « loi de Dittmar » s’énonce « … la teneur globale en sel varie d’un échantillon (d’eau de mer) à l’autre, cependant tous les échantillons contiennent les mêmes ingrédients et dans des proportions identiques, les uns par rapport aux autres… ». Cette loi des proportions constantes est encore utilisée à l’heure actuelle mais les définitions des différents paramètres caractérisant l’eau de mer, dont la salinité, ont considérablement évolué.
L’UNESCO s’est penchée sur le problème et a réalisé une approche thermodynamique englobant plusieurs paramètres physiques tels la pression, la température, la masse volumique, etc. Elle s’est concrétisée par la mise au point d’une « Équation d’état de l’eau de mer » baptisée EOS-8024. En 2010, elle a mis à jour toutes ces données et a adopté une nouvelle version de cette équation qui a été rebaptisée « Thermodynamic Equation Of Seawater » (TEOS-10)25. Celle-ci, construite selon des algorithmes numériques, est résolue informatiquement et est utilisée principalement en océanographie.
Définitions
On appelle salinité la quantité exprimée en grammes d’ions inorganiques dissous dans un kg d’EdM. En océanographie, on considère plusieurs aspects de ce paramètre (avec chacun une définition différente) dérivés de TEOS-10, leur étude n’entre pas dans le cadre de RECYCLABS.
La salinité moyenne de l’EdM dans l’océan mondial est S = 35, ce qui implique que l’EdM contient 3,5% de « sels dissous » et 96,5 % d’eau (en masse !).
Méthodes de mesure
Idéalement, il faudrait utiliser une méthode directe c.-à-d. par évaporation complète de l’eau et mesure gravimétrique des solides résiduels. Toutefois, cette technique n’est pas valable étant donné que la plupart des sels sont hygroscopiques et que certains d’entre eux se décomposent en produits volatils suite au chauffage ; ce qui donne un résultat erroné.
Plusieurs techniques indirectes ont été développées pour pallier ce problème :
- La méthode volumétrique par titration de Sørensen.26
- La densimétrie. La densité/masse volumique sont fonction de la salinité.
- La réfractométrie. L’indice de réfraction est fonction de la salinité.
- La conductimétrie. Application de la loi de Kohlrausch (voir annexe 1).
Les 3 premières méthodes sont relativement simples et donnent de bons résultats reproductibles.
La conductimétrie est plus précise mais nécessite une bonne calibration des conductimètres.
En océanographie, on utilise des appareils assez pointus qui comparent la conductivité d’un échantillon d’EdM avec celle d’un étalon standardisé de conductivité ; ces appareils, plus professionnels, sont appelés salinomètres. En ce qui concerne RECYCLABS, nous aborderons les 4 méthodes sans utiliser d’appareils sophistiqués et onéreux.
Les échantillons
Les prélèvements d’EdM « naturelle » sont effectués dans la baie de Roses (Catalogne, Espagne). Les résultats sont comparés à de l’EdM synthétique utilisée en aquariophilie marine et à de l’EdM alimentaire afin d’obtenir des points de comparaison.
Mode opératoire
Voir : Protocoles expérimentaux
Densimétrie/Réfractométrie/Conductimétrie: rappel des notions correspondantes : voir Annexe 3.
Résultats
Les tableaux suivants regroupent les différentes valeurs obtenues expérimentalement par les méthodes considérées et pour les trois échantillons d’EdM d’origine différentes.
La détermination exacte de la salinité d’un échantillon d’EdM se heurte à la question suivante : quelle est la « bonne » méthode ?
Comme expliqué plus haut, en océanographie professionnelle on utilise des salinomètres basés sur la mesure du rapport de conductivité entre celle d’un échantillon et celle d’une EdM standard27 . Ces appareils peuvent donner un résultat avec une précision atteignant ± 2.10-3 unités de salinité. En ce qui concerne RECYCLABS, le mieux est de comparer les différents résultats obtenus avec une valeur théorique calculée d’après TEOS-10. La salinité est exprimée ici en g.kg-1.
Les origines des échantillons sont les suivantes :
– Côte mer Méditerranée occidentale (« naturelle »), Empuriabrava, baie de Roses (Espagne).
– Agua de Mar Mediterranea (« alimentaire »). Origine : mer Méditerranée occidentale.
– Sel pour aquariophilie hw Marinemix 33,5 g.L-1 (« reconstituée »).
| Densité/Salinité | ||||||
|---|---|---|---|---|---|---|
| Densimètre à flotteur (20°C) | Réfractométrie (20°C) | |||||
| Digital | Visuel | |||||
| Densité | Salinité28 | Densité | Salinité | Densité | Salinité | |
| EdM naturelle | 1,027 | 37,93 | 1,028 | 37 | 1,028 | 38 |
| EdM alimentaire | 1,028 | 39,24 | 1,028 | 37 | 1,028 | 38 |
| EdM reconstituée | 1,019 | 27,43 | 1,021 | 27 | 1,020 | 27 |
| Salinité Mohr (Dittmar) | Conductivité/Salinité | Salinité TEOS-10 basée sur29 : | ||||
|---|---|---|---|---|---|---|
| Titrage K2CrO4 | Titrage conductimétrique | μS.cm-1 | Salinité30 | Densité | Conductivité | |
| EdM naturelle | 37,57 | 33,75 | 51.045 | 37,58 | 37,95 | 37,6 |
| EdM alimentaire | 37,88 | 34 | 51.940 | 38,33 | 39,25 | 38,35 |
| EdM reconstituée | 31,74 | 24,1 | 39.448 | 28,17 | 27,4 | 28,15 |
Discussion des résultats
Parmi les quatre techniques qui ont été utilisées pour étudier la salinité, seule la détermination par le titrage conductimétrique donne des valeurs anormales, inférieures de 10% pour les EdM naturelle et alimentaire et jusqu’à 24% pour l’EdM reconstituée, par rapport au titrage avec indicateur de précipitation. Le titrage conductimétrique n’étant pas sujet à des erreurs d’appréciation du point d’équivalence de la part de l’opérateur car il apparaît objectivement sur le graphique σ = f (VAg+ ajoutés) , on peut s’interroger sur la raison de cette anomalie. Celle-ci pourrait provenir de la dilution extrême des échantillons lors du titrage (175 x), qui provoquerait une sous-estimation du point d’équivalence ; ceci est à vérifier. Mis à part cette constatation, les autres méthodes donnent des résultats fort similaires et reproductibles. Le titrage avec K2CrO4 comme indicateur de point d’équivalence donne même des résultats pratiquement identiques aux méthodes physiques (densité, réfractométrie et conductimétrie).
On voit que l’EdM alimentaire a une salinité très légèrement supérieure à l’EdM naturelle, ce qui s’explique par le fait que le lieu de prélèvement de l’EdM naturelle se situe près d’une zone où une eau plus douce peut venir se mélanger. A noter que la salinité moyenne de la mer Méditerranée occidentale est de 37,5 g.kg-1. Le produit destiné à l’aquariophilie marine (sels solides) annonce une densité de 1,020 pour une concentration de 33,33 g.L-1, ce qui est vérifié. Si les sels utilisés n’étaient pas « humides » (hygroscopiques) on obtiendrait une salinité de 32,68 g.kg-1. Or, on obtient une valeur de ≈ 28, ce qui indique bien que les sels ont absorbé une certaine quantité d’eau atmosphérique avant la reconstitution.
Le sel marin : simulation d’un marais salant
Voir : Nouvelles expériences intéressantes.
2.2.7. Conclusions générales.
Cette étude de l’eau, un produit des plus banals, basée sur des concepts physiques et chimiques et effectuée dans le cadre de RECYCLABS, a permis d’intégrer beaucoup de notions abordées dans l’enseignement sans utiliser des moyens onéreux et sophistiqués. Des manipulations simples permettent de se rendre compte de la réalité de notre environnement et de l’évolution de celui-ci.
En outre, les résultats obtenus sont fiables et reproductibles, ce qui est la preuve qu’un environnement de travaux pratiques basique mais bien géré permet d’avoir accès au raisonnement scientifique. Idéalement, les résultats obtenus devraient se soumettre à une étude statistique (calculs d’erreurs, multiplication des manipulations …); cette activité essentiellement mathématique est ici laissée à l’usage des intervenants, ceci afin d’éviter un alourdissement du contenu.
Cette première partie intitulée « La vie et l’eau » constitue un premier volet de sujets expérimentaux ; les suivants seront plus axés sur les aspects biochimiques et physiologiques du vivant.
Notes & Références
- http://www.who.int/water_sanitation_health/dwq/guidelines/fr/
- La solvatation est le phénomène physico-chimique observé lors de la dissolution d’une substance chimique dans un solvant.
- https://www.geo.fr/environnement/niveau-de-co2-dans-lair-une-hausse-de-50-par-rapport-a-lere-pre-industrielle-alertent-des-chercheurs-210251
- http://www.goa-on.org
- En chimie, une solution tampon est une solution qui maintient approximativement le même pH malgré l’addition de petites quantités d’un acide ou d’une base ou à la suite d’une dilution.
- Fiche technique Supelco 1.11109.0001 MQuant® Test Alcalinité. Capacité pour acides jusqu’à pH 8,2 et pH 4,3.
- Le pH des eaux du lac Tanganyika (Afrique) varie de 8,6 à 9,5! Il possède néanmoins une biodiversité remarquable.
- D’après : http://nicole.cortial.net/complements/chimie/alcalinite/tac-ta.pdf
- En chimie la stœchiométrie, du grec ancien στοιχεῖον / stoikheîon (« élément ») et μέτρον / métron (« mesure »), est un calcul qui permet d’analyser les quantités de réactifs et de produits qui sont en jeu au cours d’une réaction chimique.
- La conductivité représente la minéralisation totale en électrolytes.
- Le baryum et le strontium sont aussi des métaux alcalino-terreux mais, étant présents à l’état de traces dans les eaux douces naturelles, leur teneur n’est pas prise en compte dans les calculs de la dureté.
- Il existe encore d’autres définitions et facteurs de conversion ; nous nous limitons ici à celles d’usage commun en Europe.
- Source : Wikipedia
- https://www.elconfidencial.com/tecnologia/ciencia/2017-10-20/analisis-aguas-minerales-solo-una-mejor-grifo_1463777/
- https://www.sfmu.org/toxin/EAU/EAU.HTM
- https://fr.wikipedia.org/wiki/Eutrophisation
- https://fr.wikipedia.org/wiki/Nitrate
- https://ec.europa.eu/environment/water/water-nitrates/index_en.htmL
- https://ec.europa.eu/commission/presscorner/detail/fr/ip_21_5109
- https://www.encyclopedie-environnement.org/eau/phosphore-et-eutrophisation/
- https://eur-lex.europa.eu/legal-content/FR/ALL/?uri=CELEX%3A32012R0259
- https://www.vivaqua.be/fr/qualite-de-leau/
- http://salinometry.com/early-determination-of-salinity-from-ancient-concepts-to-challenger-results/3/
- Equation of State. Algorithms for computation of fundamental properties of seawater. UNESCO technical papers in marine sciences, 44.1983.
- http://www.teos-10.org
- Appelée aussi méthode de Mohr-Knudsen, mise au point en 1903.
- https://osil.com/product-category/seawater-standards-salinometers/
- D’après http://envlit.ifremer.fr/var/envlit/storage/documents/dossiers/prelevementhydro/chapitre8.htmL (données plus consultables en ligne)
- https://monrecifamoi.saulme.fr/salinite/sea_water_calculator_teos10.php?style=monrecifamoi
- Calculé d’après http://envlit.ifremer.fr/var/envlit/storage/documents/dossiers/prelevementhydro/chapitre8.htmL (données plus consultables en ligne)
