Le potentiel hydrogène (pH)
Rappel de notions fondamentales concernant les réactions acido-basiques1.
1) Le pH
En 1893, le chimiste danois Søren Sørensen (1868-1939), qui travaille alors au laboratoire Carlsberg à Copenhague sur les effets des concentrations de quelques ions sur des protéines lors des processus de fabrication de la bière, remarque l’importance des ions hydrogène et décide d’introduire le concept de pH.

Dans toute solution aqueuse le produit des concentrations en ions H3O+ et OH– est une constante appelée produit ionique de l’eau Kw :
Kw = [H3O+][ OH -] = 1.10-14 M2 (moles2.L-2 ) à 25°C
Cette valeur représente en fait la constante d’équilibre de la réaction d’ autoprotolyse de l’eau:
H2O + H2O ⇋ H3O+ + OH–
Le pH est une mesure de l’acidité d’une solution aqueuse et est défini par:
pH = – log [H3O+] soit 10-pH = [H3O+] (exprimé en moles.L-1)
Une solution est définie comme :
- neutre, si dans celle-ci, [H3O+] = [OH–]
- acide si, dans celle-ci, [H3O+] > [OH–]
- basique si, dans celle-ci, [H3O+] < [OH–]
D’après la définition du produit ionique de l’eau, on a:
log ([H3O+][ OH– ]) = log (1.10-14 ) = – 14
log ([H3O+]) + log ([OH–]) = – 14 ⇒ – log ([H3O+]) – log ([OH–]) = 14
Posons pOH = – log ([OH–]), il vient pH + pOH = 14
Dans une solution neutre : [H3O+] = √1.10-14 M = 10-7 M, ⇒ le pH = 7
Dans une solution acide le pH < 7 car [H3O+] > 1.10-7 M
Dans une solution basique le pH > 7 car [H3O+] < 1.10-7 M
A 25°C, les valeurs du pH varient entre 0 et 14.
Remarque
D’un point de vue strictement théorique, ceci constitue une approximation valable pour des solutions aqueuses diluées dans lesquelles 1 M > [H3O+] > 1.10-14 M. Si ce n’est pas le cas, le calcul et la mesure du pH deviennent plus complexes et il faut se baser sur d’autres modèles.
2) Définitions
Il existe trois définitions de la notion d’acide et de base.
Historiquement, les premières définitions sont celles d’Arrhenius2:
- un acide est une entité capable de libérer un ion H+
- une base est une entité capable de libérer un ion OH–
Ces deux définitions se basent sur le comportement de substances en solution aqueuse.
Les définitions de Brønsted-Lowry3 généralisent celles d’Arrhenius:
- un acide : une espèce chimique susceptible de céder un ou plusieurs protons (ion H+)
- une base : espèce chimique susceptible de capter un ou plusieurs protons
Ces deux nouvelles définitions sont applicables à d’autres solvants que l’eau.
Enfin celles de Lewis4, qui sont les plus générales :
- Un acide est une molécule ou un ion porteur d’une lacune électronique. C’est un accepteur de doublet électronique.
- Une base est une molécule ou un ion possédant un doublet électronique libre. C’est un donneur de doublet électronique.
3) « Force » des acides et des bases
On définit un acide fort ou une base forte et un acide faible ou une base faible selon que l’espèce chimique est complètement ou partiellement dissociée en solution aqueuse. Il n’y a que quelques rares acides et bases qui soient forts. La plupart des acides et des bases ne sont, lorsqu’on les dissout dans l’eau, que partiellement dissociés en leurs ions constitutifs. Le mécanisme de la dissociation d’un acide ou d’une base est soumis aux lois de l’équilibre chimique5. Les définitions d’Arrhenius et de Brønsted-Lowry, s’appliquant principalement aux solutions aqueuses, suffisent amplement pour analyser les propriétés de l’eau.
4) Comment mesure-t-on le pH ?
Il existe principalement deux méthodes de mesure du pH :
- les indicateurs colorés (substances changeant de couleur en fonction du pH)
- le pH mètre (instrument)
Les indicateurs colorés
Les indicateurs colorés (pH indicators) fonctionnent selon les propriétés halochromiques d’un matériau. L’halochromisme est la propriété de changer de couleur en fonction de certains facteurs, ici du pH. L’indicateur coloré est un indicateur chimique de l’ion oxonium H3O+.
Les chimistes du XVIIe siècle connaissaient l’usage des indicateurs colorés. L’apothicaire français Nicolas Lémery (1645-1715) est le premier chimiste à avoir décrit les propriétés de certains indicateurs utilisés à son époque (sans pour autant connaître la notion de pH !). Actuellement, il en existe environ 70. Il est intéressant de constater qu’il existe des indicateurs de pH naturels. Le plus ancien étant le litmus, un extrait de lichen connu déjà au Moyen-Âge. La plupart sont des extraits aqueux de plantes contenant des anthocyanines, par ex. le chou rouge, qui changent de couleur en fonction du pH. Le litmus (appelé aussi papier de tournesol) est principalement fabriqué à partir du lichen Roccella tinctoria. L’extrait, adsorbé sur du papier filtre, apparaît bleu pour des pH < 4,5 et rouge pour des pH > 8,3. Les anthocyanes présentes dans les feuilles de chou rouge (Brassica oleracea var. capitata f. rubra) présentent diverses colorations en fonction du pH. Le jus de ce légume est un « indicateur universel » naturel.

Le pH-mètre
Cet appareil se compose toujours de deux éléments:
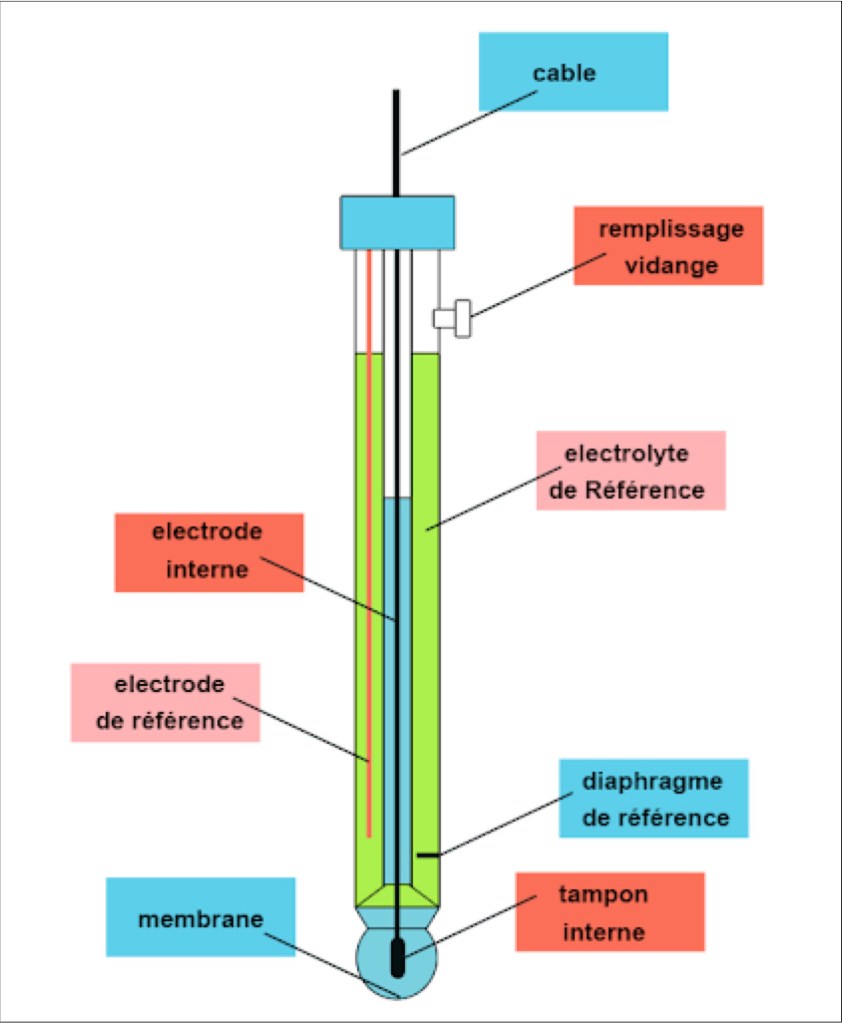
- Une électrode de mesure de type « électrode de verre ». Cette électrode est actuellement une électrode « combinée » comprenant en fait deux électrodes : une électrode de référence et une électrode de mesure proprement dite.
- Une unité de contrôle et de lecture : un millivoltmètre.

En général, les deux éléments sont distincts et reliés par un câble conducteur. Il existe aussi des systèmes compacts, simplifiés, où l’électrode est solidaire du boîtier de contrôle (pH-mètres de poche).
Le fonctionnement du pH mètre est basé sur des principes d’électrochimie. Si l’unité de contrôle/lecture consiste principalement en un (milli)voltmètre, l’électrode de mesure fonctionne en application d’une formule d’électrochimie appelée « Équation de Nernst »6.
L’architecture de l’électrode est assez complexe et la compréhension de son fonctionnement nécessite une bonne connaissance de l’équation de Nernst et des propriétés physicochimiques du verre. Nous ne développerons pas ces aspects ici (voir un cours de Chimie Analytique).
Mis au point par l’ingénieur américain Arnold Beckman (1900-2004) dans les années 1930 et appelés d’abord « acidimètres », les premiers pH-mètres furent utilisés dans l’industrie citricole en Californie (Sunkist). Le premier pH-mètre transportable fut breveté aux Etats-Unis en 1934 et pesait environ 7 kg. Beckman inventa d’autres appareils fondamentaux pour la recherche scientifique et fut un des pionners de la « Silicon Valley ». A noter que l’électrode de verre avait déjà été mise au point par le chimiste allemand Fritz Haber (1868-1934) en 1909.
Notes & Références
- Mc Quarrie / Rock. Chimie Générale. De Boeck Université. 3ième édition 1992 (chapitre 18).
- Svante August Arrhenius (1859 – 1927) est un chimiste suédois, pionnier dans de nombreux domaines. Il reçoit le prix Nobel de chimie en 1903.
- Théorie de Brønsted-Lowry: elle porte les noms des chimistes anglais Thomas Lowry et danois Joannes Brønsted qui l’énoncèrent indépendamment en 1923.
- Gilbert Newton Lewis (1875 – 1946) est un physicien et chimiste américain. Il a été nommé 41 fois pour le prix Nobel de chimie, mais ne l’a jamais obtenu !
- Voir un cours de Chimie Générale (Mc Quarrie/Rock, Dunod Université par ex.).
- Walther Hermann Nernst (1864-1941) est un physicien et chimiste allemand, lauréat du prix Nobel de chimie de 1920. Il a mené de nombreuses recherches dans les domaines de l’électrochimie, de la thermodynamique, de la chimie du solide et de la photochimie.
